En ny upptäckt vid Åbo Akademi beskriver livsviktiga funktioner som styr bildningen av nya blodkärl. En större förståelse för dessa lägger grunden för effektivare verktyg mot bland annat cancer och inom regenerativ medicin.
Text & foto: Nicklas Hägen.
CELLERNA I KROPPEN ”känner av” sin omgivning genom signalering. Denna ständigt pågående kommunikation mellan cellen och dess närmiljö bestämmer en mängd olika saker. Bland annat avgör den vilken typ av cell som cellen utvecklas till, om cellen ska växa eller dö, och gör det möjligt för cellerna att anpassa sig till förändringar i omgivningen – till exempel i tryck eller temperatur.
Exakt hur dessa komplexa molekylära processer går till är ett fält av frågor cellbiologisk grundforskning försöker ge beskrivande svar på. För varje steg denna forskning tar öppnar sig i förlängningen nya möjligheter för förbättrade läkemedel eller terapier.
En viktig bit i det stora pusslet upptäcktes nyligen av professor Cecilia Sahlgrens forskargrupp i cellbiologi vid Åbo Akademi. I en artikel publicerad i den amerikanska tidskriften PNAS den 22 maj 2017 visar forskarna för första gången hur en specifik del av cellens cytoskelett binder till specifikt ett av två signalerande proteiner – så kallade ligander – i en signalräcka som styr bildningen av nya blodkärl.
– Det här har länge varit en fundamental grundfråga. Det som är terapeutiskt intressant är att man vet att mutationer i den här signalräckan är starkt anknutet till cancer och hjärt- och kärlsjukdomar, och att man genom att modifiera den kan styra vävnadstillväxten, säger Sahlgren.
Doktorand Daniel Antfolk tillägger:
– För en vuxen individ behövs nya blodkärl främst för att ge musklerna tillräckligt med näring om man tränar. Men nya blodkärl kan också orsakas av inflammationer eller i samband med cancer. Tumörer kan inte bli större än några millimeter om de inte har en egen blodförsörjning, säger Antfolk.
Att kunna styra blodkärlsbildningen skulle därför vara ett viktigt medicinskt verktyg. Genom att minska signalerna mellan cellerna borde man kunna kväsa tillväxten av nya blodkärl och förhindra tumörtillväxt och metastasering i cancer. Genom att å andra sidan sätta igång en aktiv signal i önskad riktning kan man styra tillväxten av blodkärl och därigenom nya vävnader, vilket behövs inom regenerativ medicin.
– Blodkärlen har tre funktioner. De bär bort avfall från vävnaden, och tillför syre och näring. De är kroppens motorvägar, säger Sahlgren.
– Kunde man på något vis påverka blodkärlsbildningen utifrån kunde man i vissa fall hindra tumörer från att växa och bilda metastaser via de här blodkärlen.
Inte bara struktur
Det forskarna har hittat är att ligandernas aktivitet styrs inifrån cellen, från det så kallade cytoskelettet – en struktur som bland annat upprätthåller cellens form.
– Det är såna här strukturer som gör att cellerna hålls ihop. Vår hud skulle till exempel inte vara så här töjbar och hållbar om det inte skulle finnas ett cytoskelett i cellerna, säger Antfolk och nyper sig i huden.
– Det är ett ganska dynamiskt skelett som cellen har, det ger inte cellen bara mekanisk styrka utan också alla former av små mekaniska skeenden inom cellen regleras av repliknande strukturer som drar och skuffar på proteiner och organeller i cellen, säger Sahlgren.
Cytoskelettet består av en mängd olika proteiner, vars art varierar beroende på var i kroppen cellen befinner sig. Under senare år har det klarnat att cytoskelettet, förutom att det ger cellen struktur, också har en viktig funktion i kommunikationen mellan cellerna.
När man rör sig in på den här nivån blir det snabbt komplicerat, men vi gör ett försök: En signalräcka som verkar vara inblandad i en mängd viktiga skeenden i cellen är den som forskarna kallar Notch. Sahlgrens grupp har, med Antfolk i spetsen, visat att en specifik del av cytoskelettet binder till de delar av Notch som gör att signalen når ut utanför cellen, ”armarna” som gör ”handslaget” i kommunikationen mellan cellerna möjlig.
Förutom ligander (signalens avsändare) pratar man i denna kommunikation också om receptorer (signalens mottagare). I signalräckan Notch signalerar två ligander till samma receptor, där den ena hämmar och den andra aktiverar utvecklingen av blodkärl.
– Det här har man vetat rätt länge. Men vad det är som gör att liganderna signalerar olika när de ser så likadana ut och binder till samma receptor har man inte förstått. Inte heller hur liganderna regleras på olika sätt, säger Sahlgren.
– Strukturellt ser liganderna alltså likadana ut. Men vi har för första gången visat att cellens cytoskelett binder specifikt till den ena liganden, inte till den andra, säger Antfolk.
Orsaken till detta finns i bindningen mellan cytoskelettet och liganden. I blodkärlscellers cytoskelett finns ett protein som heter vimentin. Proteinet binder till liganden och fungerar som ett rep: vimentinet drar i liganden när denna i sin tur binder till receptorn.
– Normalt har varje interaktion mellan molekyler eller proteiner en viss affinitet, en benägenhet att reagera med varandra. Om du börjar slita och dra i dem så går de ifrån varandra, deras affinitet minskar och den tid de är bundna till varandra blir mindre, säger Sahlgren.
– Men samspelet mellan ligand och receptor är vad man kallar en ”catch bond”, där affiniteten ökar när man drar i dem. Det finns en kinesisk leksak, en så kallad fingerfälla, som spänner åt när man drar ut fingret ur den. Bindningen mellan ligand och receptor fungerar på samma sätt. Cytoskelettet drar specifikt i den ena liganden och därför stärker den signalen från just den. Båda liganderna signalerar hela tiden, men signalerar den ena starkare blir det inga nya blodkärl och signalerar den andra starkare blir det nya blodkärl. Nu har vi visat att orsaken till hur starkt de signalerar är just det här repet, vimentinet.
Nytt hopp för gamla läkemedel
Upptäckten är ett steg in på ett område man kunde kalla cellulär finreglering, där man styr mekanismer genom att minska och öka signaler i stället för att helt knäppa dem av eller på.
– Finreglering har saknats inom fältet, men det är på kommande, säger Sahlgren.
När det handlar om sjukdomar relaterade till Notch-signaleringen är finreglering precis vad som behövs. Eftersom Notch är en mycket fundamental signalmekanism fungerar den i alla organ, inte bara under utvecklingsstadiet utan också i den vuxna kroppen. Och mutationer i Notch länkar till en mängd olika sjukdomar, allt från hjärt- och kärlsjukdomar, till neurologiska sjukdomar, inflammatoriska och metaboliska sjukdomar, samt cancer.
– Det finns en massa olika läkemedel som manipulerar Notch-signalen. De är effektiva och av olika typer så att vi specifikt kan inhibera ligander eller receptorer, men de ger så förbannat svåra sidoeffekter, säger Sahlgren.
– Det första läkemedlet mot Notch som kom på marknaden var ursprungligen tänkt för att inhibera alzheimer, genom att förhindra klyvningen av vissa proteiner som ger upphov till sjukdomen. Man var tvungen att dra bort läkemedlet på grund av bieffekterna. Orsaken till bieffekterna var att läkemedlet bröt Notch-signalräckan.
Antfolk säger att detta och andra liknande läkemedel ännu kunde vara användbara, bara man lär sig styra var i kroppen och i vilken grad man manipulerar Notch-signaleringen.
– De första läkemedlen går ännu att använda, om man kan göra dem specifika. Det man testade med de första läkemedlen var en vanlig administration som går ut över hela kroppen. Men man skulle på något vis behöva få den där det behövs och när det behövs. Man kanske inte alltid vill ha en full utslagning av proteinet, utan man borde kunna modulera det, säger Antfolk.
För att göra det är ÅA-forskarnas upptäckt av hur cytoskelettets vimentin styr signalstyrkan i de två liganderna en bra plattform att bygga vidare kunskap på. Sahlgren säger att upptäckten ger verktyg att justera Notch-signalen.
– Nu vet vi att om vi går in med celler som saknar ”repet” som drar i liganden så skruvar vi ner signalen. Om vi kapar repet i till exempel cancerceller tar det inte bort signalen helt, men skruvar ner den. Sedan ser vi om det räcker för att förhindra cancertillväxt eller metastasbildning, vilket ger oss en plattform för att förstå att om det lönar sig att gå in och inhibera signalen helt, säger Sahlgren.
– En förståelse för hur signaleringen i och mellan celler fungerar är viktig för att man ska kunna förbättra behandlingen av sjukdomar. Om man bara riktar in sig på läkemedelsutveckling kan man förbigå detaljer i förståelsen för helheten som gör att man visserligen får fram en medicinsk produkt, men den kan vara långt ifrån så bra som den kunde vara om man förstod de bakomliggande mekanismerna.
Ett av de snabbaste tillämpningsområdena av upptäckten av hur cytoskelettet kommunikationen mellan cellerna är inom regenerativ medicin. Sahlgrens forskargrupp har lyckats styra mönstret på tillväxten av blodkärl i cellodlingar.
– När man ska skapa ny vävnad är en av de viktigaste utmaningarna att den nya vävnaden infiltreras med blodkärl. Annars blir den inte fungerande. Regenerativt kan man kanske börja leka med mekanismerna och aktivera eller inhibera dem beroende på vad som behövs.
Betyder det här att jag kommer att kunna växa ut en tredje arm?
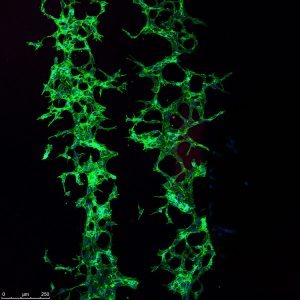
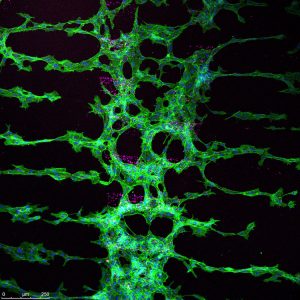
– Det här har en funktionell betydelse, men vi rör oss bara i blodkärl än så länge. Vi gjorde ett snyggt arbete där vi använde liganderna för att skapa 2D-strukturer av blodkärl. Vi printade liganderna och fick blodkärlen att växa enligt det mönster vi skapade.
– Vi gjorde alltså mönster av den aktiverande Notch-liganden runt existerande blodkärl, vilket fick blodkärlen att börja växa ut. Vi kunde alltså styra utväxten av blodkärl genom att ställa balansen mellan de två liganderna. Man ser att det börjar knoppa och bildas nya blodkärl.
– På det här sättet kan vi styra strukturen, och det är viktigt att få en nätverksstruktur när du har ett blodkärl. Det är den långsiktiga applikationsmöjligheten. Som nästa steg försöker vi trycka liganderna i olika mönster och form i en 3D-struktur.